María Belén García Altamirano
C.E Prof. Gregorio de Gante
Química
1-D
Leyes ponderales o de la combinación química.
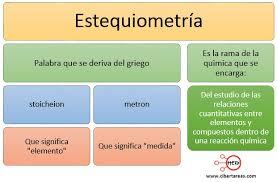
La estequiometría es la información de las cantidades de los reactantes y productos en una reacción química. Esta se basa en que la cantidad de reactantes es igual a la cantidad de los productos y que los compuestos tienen una composición fija.
La palabra "estequiometría" deriva del griego stoicheon (elemento) y metron (medida). Fue aplicada por Jeremias Benjamin Richter en 1792.
Un coeficiente estequiométrico es el número que aparece delante de la fórmula química en una ecuación. Por ejemplo, en la reacción de descomposición del agua H2O se produce hidrógeno H2 y oxígeno O2 en forma de gas:
En este caso, el H2O y el H2 tienen un 2 como coeficiente estequiométrico, mientras el O2 no tiene ningún coeficiente. Esto significa que 2 moléculas de H2O se transforman en 2 moléculas de H2 y 1 molécula de O2.
La estequiometría está presente en la vida cotidiana. Cuando hacemos un pastel, tenemos que usar unas cantidades fijas de ingredientes (reactantes) para obtener un pastel (producto). Si utilizamos más polvo de hornear que harina, el resultado probablemente no será el deseado.
Leyes ponderales de la química: Estas leyes son: la ley de conservación de la masa, la ley de las proporciones constantes o definidas y la ley de las proporciones múltiples. El establecimiento de estas tres leyes jugó un papel fundamental en el desarrollo de la teoría atómico-molecular de la materia.
¿Cuáles son las 5 leyes ponderales?
Índice
- 1.1 Ley de Lavoisier o de conservación de la masa.
- 1.2 Ley de Proust o de las proporciones constantes.
- 1.3 Ley de Dalton o de las proporciones múltiples.
- 1.4 Ley de Richter o de las proporciones equivalentes o recíprocas.
- 1.5 Ley de Gay-Lussac o de los volúmenes de combinación
3.ley de la conservación de la Masa: principio de consevación de la masa o ley de Lavoisier.
La materia ni se crea ni se destruye, sólo se transforma. En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.Cuando una vela arde no se gana ni se pierde masa. La masa total de la cera y del oxígeno molecular (O2) presente antes de la combustión es igual a la masa total de dióxido de carbono (CO2), vapor de agua (H2O) y cera sin quemar que quedan cuando la vela se apaga.
4. ley de las proporciones definidas : La ley de las proporciones definidas también fue expresada por Lavoisier e indica que los compuestos químicos tienen poseen una composición definida o constante: "Cuando dos o más elementos se combinan para formar un compuesto dado, la razón entre las masas de los elementos que intervienen es siempre la misma."
calculo de la masa molecular: Se calcula mediante la suma de las masas atómicas de los átomos que constituyen la molécula. Puede expresarse en uma o en gramos. Cuando se expresa en uma nos referimos a la masa de una molécula, mientras que si se hace en gramos la masa molecular se refiere al NA de moléculas.
ley de las proporciones Múltiples: La ley de las proporciones múltiples fue enunciada por John Dalton, en el año 1803, y es una importante ley estequiométrica. Fue demostrada en la práctica por el químico francés Gay-Lussac.Esta ley indica que cuando dos elementos A y B, son capaces de combinarse entre sí para formar varios compuestos distintos, las distintas masas de B que se unen a una cierta masa de A, están en relación de números enteros y sencillos.






Comentarios
Publicar un comentario